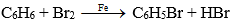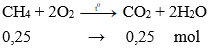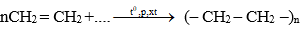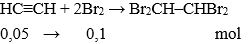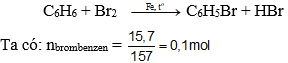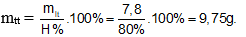Lý thuyết Hóa học 9 Chương 4 (mới 2022 + 10 câu trắc nghiệm): Hiđrocacbon – Nhiên liệu
Với tóm tắt lý thuyết Hóa học lớp 9 Luyện tập chương 4 : Hiđrocacbon – Nhiên liệu hay, chi tiết cùng với 10 câu hỏi trắc nghiệm chọn lọc có đáp án giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học lớp 9.
Hóa học 9 Chương 4: Hiđrocacbon – Nhiên liệu
A. Lý thuyết Chương 4: Hiđrocacbon – Nhiên liệu
Lý thuyết cần nhớ
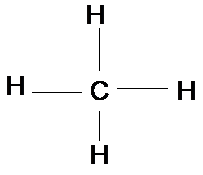
Metan
(CH4)
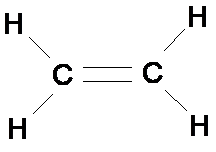
Etilen
(C2H4)
Axetilen (C2H2)
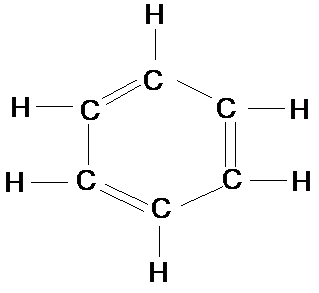
Benzen (C6H6)
Công thức cấu tạo
![]()
Đặc điểm cấu tạo của phân tử
Chỉ có liên kết đơn
Có một liên kết đôi (gồm 1 liên kết bền và 1 liên kết yếu)
Có một liên kết ba (gồm 1 liên kết bền và 2 liên kết yếu).
Mạch vòng 6 cạnh, có 3 liên kết đôi xen kẽ 3 liên kết đơn
Phản ứng đặc trưng
Phản ứng thế
Phản ứng cộng.
Phản ứng cộng.
Vừa có phản ứng thế vừa có phản ứng cộng.
Ứng dụng chính
Nhiên liệu trong đời sống.
Nguyên liệu sản xuất chất dẻo, rượu etylic, axit axetic, cloetan…
Nguyên liệu sản xuất chất dẻo, axit axetic, nhiên liệu đèn xì oxi – axetilen…
Nguyên liệu sản xuất chất dẻo, phẩm nhuộm, thuốc trừ sâu …
Các phương trình hóa học minh họa tính chất
– Metan
+ Tác dụng với clo khi có ánh sáng:
H HH−C−H+Cl−Cl→Ánh sángH−C−Cl+HCl H H
Viết gọn: CH4 + Cl2 →Ánh sáng CH3Cl + HCl
+ Tác dụng với oxi:
CH4 + 2O2 →t0 CO2 + 2H2O
– Etilen
+ Tác dụng với dung dịch brom:
H H H HC=C + Br−Br→Br−C−C−BrH H H H
Viết gọn: CH2 = CH2 + Br2 → Br – CH2 – CH2 – Br
+ Tác dụng với oxi:
C2H4 + 3O2 →t0 2CO2 + 2H2O
+ Các phân tử etilen kết hợp với nhau:
….+ CH2 = CH2 + CH2 = CH2 +…. →t0,p,xt ….– CH2 – CH2 – CH2 – CH2 – ….
Viết gọn: nCH2 = CH2 +…. →t0,p,xt (– CH2 – CH2 –)n
– Axetilen
+ Tác dụng với dung dịch brom:
HC ≡ CH + Br2 → Br–CH=CH– Br
Sản phẩm mới sinh ra có liên kết đôi trong phân tử nên có thể cộng tiếp với 1 phân tử brom nữa:
Br–CH=CH– Br + Br2 → Br2CH–CHBr2
Tổng quát:
HC≡CH + 2Br2 → Br2CH–CHBr2
+ Tác dụng với oxi:
2C2H2 + 5O2 →t0 4CO2 + 2H2O
– Benzen
+ Phản ứng thế với brom:
C6H6 (l) + Br2 (l) HBr (k) + C6H5Br (l)
+ Tác dụng với oxi:
2C6H6 + 15O2 →t0 12CO2 + 6H2O
+ Tham gia phản ứng cộng với H2:
C6H6 + 3H2 →Ni,t0 C6H12
B. Trắc nghiệm Chương 4: Hiđrocacbon – Nhiên liệu
Bài 1: Chất có khả năng làm mất màu dung dịch brom là
A. CO2.
B. C2H4.
C. C2H6.
D. CH4.
Đáp án: B
Bài 2: Khí tham gia phản ứng trùng hợp là
A. CH4.
B. C2H4.
C. C3H8.
D. C2H6.
Đáp án: B
Bài 3: Chất khi tác dụng với nước sinh ra khí axetilen là
A. Al4C3.
B. CaC2.
C. CaO.
D. Na2S.
Đáp án: B
CaC2 + 2H2O → Ca(OH)2 + C2H2
Bài 4: Phân biệt metan và etilen dùng dung dịch nào sau đây ?
A. Br2
B. NaOH
C. NaCl
D. AgNO3 trong NH3
Đáp án: A
Khí etilen làm mất màu dung dịch brom ngay điều kiện thường, còn khí metan thì không.
C2H4 + Br2 → C2H4Br2
Bài 5: Benzen tác dụng với Br2 theo tỷ lệ mol 1 : 1 (có mặt bột Fe), thu được sản phẩm hữu cơ là
A. C6H6Br2
B. C6H6Br6
C. C6H5Br
D. C6H6Br4
Đáp án: C
Bài 6: Khi đốt cháy hoàn toàn 0,25 mol metan người ta thu được một lượng khí CO2 (đktc) có thể tích là
A. 5,6 lít.
B. 11,2 lít.
C. 16,8 lít.
D. 8,96 lít.
Đáp án: A
VCO2 = 0,25.22,4 = 5,6 lít.
Bài 7: Trùng hợp 14 gam etilen (với hiệu suất 100 %) ở điều kiện thích hợp thì thu được khối lượng polietilen là
A. 7 gam.
B. 14 gam.
C. 28 gam.
D. 56 gam.
Đáp án: B
Bảo toàn khối lượng có:
mtrước = msau ⇔ mpoli etilen = metilen = 14 gam.
Bài 8: Dẫn 0,05 mol khí axetilen qua bình đựng dung dịch nước brom dư. Khối lượng brom tham gia phản ứng là
A. 16,0 gam.
B. 20,0 gam.
C. 26,0 gam.
D. 32,0 gam.
Đáp án: A
→ mBrom pư = 0,1.160 = 16 gam.
Bài 9: Một hợp chất hữu cơ A có phân tử khối là 28 đvC. Vậy A là
A. axetilen.
B. metan.
C. etilen.
D. benzen.
Đáp án: A
Bài 10: Tính khối lượng benzen cần dùng để điều chế được 15,7 gam brombenzen ? Biết hiệu suất phản ứng là 80%
A. 15,6 gam.
B. 7,8 gam.
C. 9,75gam.
D. 16 gam.
Đáp án: C
Theo PTHH có: nbenzen = nbrombenzen = 0,1 mol
→ Khối lượng benzen theo lý thuyết: mLT = n.M = 0,1.78 = 7,8 gam.
Do hiệu suất phản ứng là 80% → khối lượng brom thực tế là: