Ôn tập Hóa học 9 Chương 1 Các loại hợp chất vô cơ
Nội Dung Chính
Đề cương ôn tập Hóa học 10 Chương 1
A. Tóm tắt lý thuyết
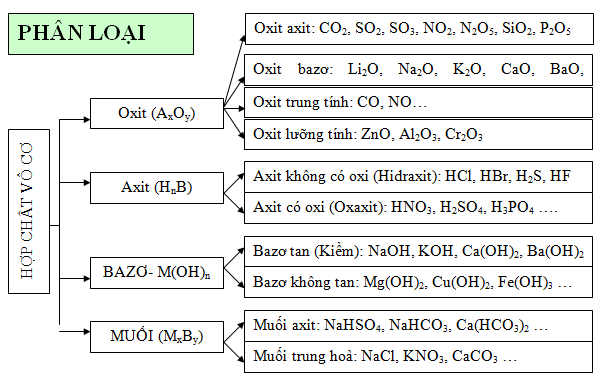
1.1. Phân loại các hợp chất vô cơ
Hình 1: Phân loại các hợp chất vô cơ
1.2. Tính chất hóa học của các loại hợp chất vô cơ
Hình 2: Mối quan hệ giữa các hợp chất vô cơ
Muối + Muối → 2Muối
Muối + Kim loại → Muối mới + Kim loại mới
Muối (t0) → Chất mới
B. Bài tập minh họa:
Bài 1:
Để một mẫu natri hiđrôxit trên tấm kính trong không khí, sau vài ngày thấy có chất rắn màu trắng phủ ngoài. Nếu nhỏ vài giọt dd HCl vào chất rắn trắng thấy có chất khí thoát ra, khí này làm đục nước vôi trong. Chất rắn màu trắng là sản phẩm phản ứng natri hiđrôxit với
a) Oxi trong không khí
b) Hơi nước trong không khí
c) Cacbon đioxit và oxi trong không khí
d) Cacbon đioxit và hơi nước trong không khí
e) Cacbon đioxit trong không khí
Hãy chọn câu đúng. Giải thích và viết PTHH minh họa ?
Hướng dẫn:
Câu đúng là câu e. Cacbon đioxit trong không khí
2NaOH + CO2 → Na2CO3 + H2O
Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
Bài 2:
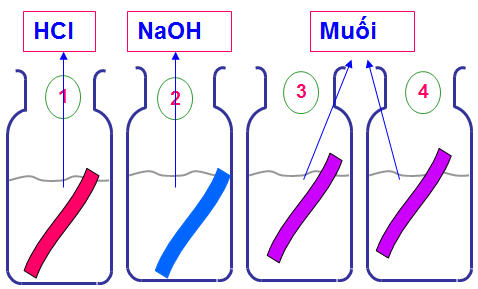
Bằng phương pháp hóa học nhận biết 4 dung dịch : HCl ,MgSO4, MgCl2, NaOH chứa trong 4 lọ mất nhãn.
Hướng dẫn:
– Đánh dấu mỗi lọ và lấy ra một ít hóa chất để thử.
– Cho giấy quỳ tím lần lượt vào 4 lọ
– Dung dịch trong lọ nào làm cho giấy quỳ tím:
– Dung dịch trong lọ nào làm không làm đổi màu giấy quỳ tím thì lọ đó chứa dung dịch MgSO4, MgCl2
– Nhỏ vài giọt BaCl2 vào hai lọ chứa dung dịch muối. Dung dịch trong lọ nào có hiện tượng kết tủa trắng là MgSO4 : BaCl2 + MgSO4 → MgCl2 + BaSO4
– Còn lại MgCl2
Bài 3:
Trộn một dd có hòa tan 0,2 mol CuCl2 với một dd có hòa tan 20 g NaOH. Lọc hỗn hợp các chất sau phản ứng, được kết tủa và nước lọc . Nung kết tủa đến khi khối lượng không đổi.
a) Viết các PTHH xảy ra ?
b)Tính khối lượng chất rắn thu được sau phản ứng?
c) Tính khối lương các chất tan có trong nước lọc?
Hướng dẫn:
a. CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl (1)
0,2mol 0,4mol 0,2mol 0,4mol
Cu(OH)2 → CuO + H2O (2)
0,2mol 0,2mol
b.Ta có:
\(\begin{array}{l} {n_{CuC{l_2}}} = 0,2mol\\ {m_{NaOH}} = 20gam \Rightarrow {n_{NaCl}} = \frac{{20}}{{40}} = 0,5(mol) \end{array}\)
So sánh: \(\frac{{0,2}}{1} < \frac{{0,5}}{2}\) ⇒ Khối lượng NaOH dư
Từ pt (1) và (2) ta có nCuO = 0,2 mol
Vậy khối lượng chất rắn tạo thành sau khi nung là: mCuO = 0,2 x 80 = 16 gam
c. Các chất tan có trong nước lọc gồm: NaOH dư , NaCl tạo thành
Từ (1) ta có : nNaOH dư = 0,5 – 0,4 = 0,1 mol
nNaCl = 0,4 mol
Vậy : mNaOH dư = 0,1 x 40 = 4 gam
mNaCl = 0,4 x 58,5 = 23,4 gam
Trắc nghiệm Hóa học 9 Chương 1
Đề kiểm tra Hóa học 9 Chương 1
Trắc nghiệm online Hóa học 9 Chương 1 (Thi Online)
Phần này các em được làm trắc nghiệm online với các câu hỏi trong vòng 45 phút để kiểm tra năng lực và sau đó đối chiếu kết quả từng câu hỏi.
Đề kiểm tra Hóa học 9 Chương 1 (Tải File)
Phần này các em có thể xem online hoặc tải file đề thi về tham khảo gồm đầy đủ câu hỏi và đáp án làm bài.
Lý thuyết từng bài chương 1 và hướng dẫn giải bài tập SGK
Lý thuyết Hóa học 9 Chương 1
Giải bài tập Hóa học 9 Chương 1
Trên đây là Ôn tập Hóa 9 Chương 1. Hy vọng với tài liệu này, các em sẽ ôn tập tốt và củng cố kiến thức một cách vững chắc. Để thi online và tải file về máy các em vui lòng đăng nhập vào trang hoc247.net và ấn chọn chức năng “Thi Online” hoặc “Tải về”. Ngoài ra, các em còn có thể chia sẻ lên Facebook để giới thiệu bạn bè cùng vào học, tích lũy thêm điểm HP và có cơ hội nhận thêm nhiều phần quà có giá trị từ HỌC247 !

.PNG)