Ôn tập Hóa học 11 Chương 2 Nitơ – Photpho
Nội Dung Chính
Đề cương ôn tập Hóa học 11 Chương 2
A. Tóm tắt lý thuyết
1. Đơn chất Photpho
Photpho
Cấu hình e
1s
2
2s
2
2p
6
3s
2
3p
3
Độ âm điện
2,19
Cấu tạo phân tử
P đỏ và P trắng → CTPT : P
Mức oxi hóa
-3, 0, +3, +5
Tính chất hóa học
Tính oxi hóa : + KL, H2
Tính khử : + O2, Cl2.
P trắng hoạt động hơn P đỏ
2. Axit Photphoric và muối Photphat
Axit H3PO4
Muối photphat
Tính chất vật lí
Tinh thể trong suốt, tonc=52,5oC háo nước → dễ chảy rữa, dd H3PO4 không màu.
Tan trong nước theo bất kì tỉ lệ nào.
Muối đihiđrophotphat (H2PO4-) tan
Muối HPO42-, PO43- của kim loại Na, K, NH4+ tan
Tính chất hóa học
Axit trung bình, ba nấc có tính chất chung của axit , Tác dụng với dd kiềm cho 3 loại muối H2PO4-, HPO42-, PO43-
Không có tính Oxi hóa
Có đầy đủ tính chất chung của muối
Khó nhiệt phân
Nhận biết ion PO43-
Thuốc thử: Dung dịch AgNO3 → Ag3PO4 ↓ vàng
3. Amoniac và muối amoni
Amoniac (NH
3
)
Muối amoni (NH
4
+)
Tính chất hóa học
Tính bazơ yếu
Tính khử
Tác dụng với kiềm
Phản ứng nhiệt phân.
Điều chế
N2 + 3H2 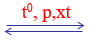
NH4++OH- 
NH
3
+ H
+
→ NH
4
+
Nhận biết
Dùng quỳ tím ẩm → hóa xanh
Dùng dung dịch kiềm
khí làm quỳ ẩm hóa xanh.
4. Axit nitric và axit photphoric
Axit nitric
(HNO
3
)
Axit photphoric
(H
3
PO
4
)
Tính chất hóa học
Axit mạnh có đầy đủ tính chất chung của axit.
Chất oxi hóa mạnh:
Tác dụng với hầu hết kim loại.
Tác dụng với một số phi kim.
Tác dụng với nhiều hợp chất có tính khử.
Axit trung bình, ba nấc có t/c chung của axit
Không có tính Oxi hóa
5. Muối nitrat và muối photphat
Muối nitrat (NO
3
–
)
Muối photphat
Tính chất hóa học
Phân hủy nhiệt:
– M: K → Ca
M(NO3)n → M(NO2)n+ n/2O2
– M: Mg → Cu
2M(NO3)n → M2On+ 2nNO2+ n/2O2
– M: sau Cu
M(NO3)n → M+ nNO2+ n/2O2
Có tính chất chung của muối.
Khó bị nhiệt phân.
Nhận biết: dùng dd AgNO
3
.
Hiện tượng: kết tủa vàng Ag
3
PO
4
B. Bài tập minh họa
Bài 1:
Lập các phương trình hoá học sau ở dạng phân tử và ion thu gọn:
a) NH3 + CH3COOH → …
b) (NH4)3PO4 → H3PO4 + …
c) Zn(NO3)2 → …
d) K3PO4 + Ba(NO3)2 → …
e) Ca(H2PO4)2 + Ca(OH)2 → …
(Tỉ lệ 1:1)
Hướng dẫn:
a) NH3 + CH3COOH → CH3COONH4
b) (NH4)3PO4 → H3PO4 + 3NH3
c) Zn(NO3)2 → ZnO + 2NO2 + 1/2O2
d) 2K3PO4 + 3Ba(NO3)2 → Ba3(PO4)2 ↓ + 6KNO3
e) Ca(H2PO4)2 + Ca(OH)2 → 2CaHPO4 + 3H2O
(Tỉ lệ 1:1)
Bài 2:
Cho 60 gam hỗn hợp Cu và CuO tan hết trong 3 lit dung dịch HNO3 1M, thu được 13,44 lit khí NO(đkc). Tính phần trăm của Cu trong hỗn hợp và tính nồng độ mol của axit trong dung dịch thu được?
Hướng dẫn:
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O (1)
CuO + 2HNO3 → Cu(NO3)2 + H2O (2)
\(\begin{array}{l} {n_{Cu}} = \frac{{3.{n_{NO}}}}{2} = \frac{{3.\frac{{13,44}}{{22,4}}}}{2} = 0,9(mol)\\ \to {m_{Cu}} = 64.0,9 = 57,6g \end{array}\)
⇒ \({n_{HN{O_3}(1)}} = \frac{{0,9.8}}{3} = 2,4mol\)
⇒ mCuO= 60-57,6=2,4g ⇒ \({n_{CuO}} = \frac{{2,4}}{{80}} = 0,03mol\)
⇒ \({n_{HN{O_3}(2)}} = 0,03.2 = 0,06mol\)
Tổng số mol HNO3 phản ứng=2,4 + 0,06=2,46mol
Số mol HNO3 ban đầu=3.1= 3 mol
⇒ Số mol HNO3 còn lại=3-2,46= 0,54mol
Xem thể tích dung dịch không đổi, nồng độ axit còn lại sau phản ứng: \({C_M} = \frac{{0,54}}{3} = 0,18M\)
Bài 3:
Từ 10m3 hỗn hợp N2 và H2 lấy theo tỉ lệ 1:3 về thể tích, có thể sản suất được bao nhiêu m3 amoniac? Biết rằng hiệu suất chuyển hoá là 95% (các khí đo ở đktc)
Hướng dẫn:
H=95% ⇒ Thể tích hỗn hợp tham gia tạo sản phẩm:
\({V_{hh}} = \frac{{10.95}}{{100}} = 9,5({m^3})\)
Tỉ lệ \({V_{{N_2}}}:{V_{{H_2}}} = 1:3\) bằng tỉ lệ trong phản ứng
N2 + 3H2 \(\leftrightarrows\)2NH3
\({V_{{N_2}}} = \frac{{1.9,5}}{4} = 2,375({m^3})\); \({V_{N{H_3}}} = 2.2,375 = 4,75({m^3})\)
Trắc nghiệm Hóa học 11 Chương 2
Đề kiểm tra Hóa học 11 Chương 2
Trắc nghiệm online Hóa học 11 Chương 2 (Thi Online)
Phần này các em được làm trắc nghiệm online với các câu hỏi để kiểm tra năng lực và sau đó đối chiếu kết quả từng câu hỏi.
Đề kiểm tra Hóa học 11 Chương 2 (Tải File)
Phần này các em có thể xem online hoặc tải file đề thi về tham khảo gồm đầy đủ câu hỏi và đáp án làm bài.
Lý thuyết từng bài chương 2 và hướng dẫn giải bài tập SGK
Lý thuyết Hóa học 11 Chương 2
Giải bài tập SGK Hóa học 11 Chương 2
Trên đây là nội dung đề cương ôn tập Hóa 11 Chương 2. Hy vọng với tài liệu này, các em sẽ giúp các em ôn tập và hệ thống lại kiến thức thật tốt. Để thi online và tải file đề thi về máy các em vui lòng đăng nhập vào trang hoc247.net và ấn chọn chức năng “Thi Online” hoặc “Tải về”. Ngoài ra, các em còn có thể chia sẻ lên Facebook để giới thiệu bạn bè cùng vào học, tích lũy thêm điểm HP và có cơ hội nhận thêm nhiều phần quà có giá trị từ HỌC247 !






