Lý thuyết về este – loigiaihay.com
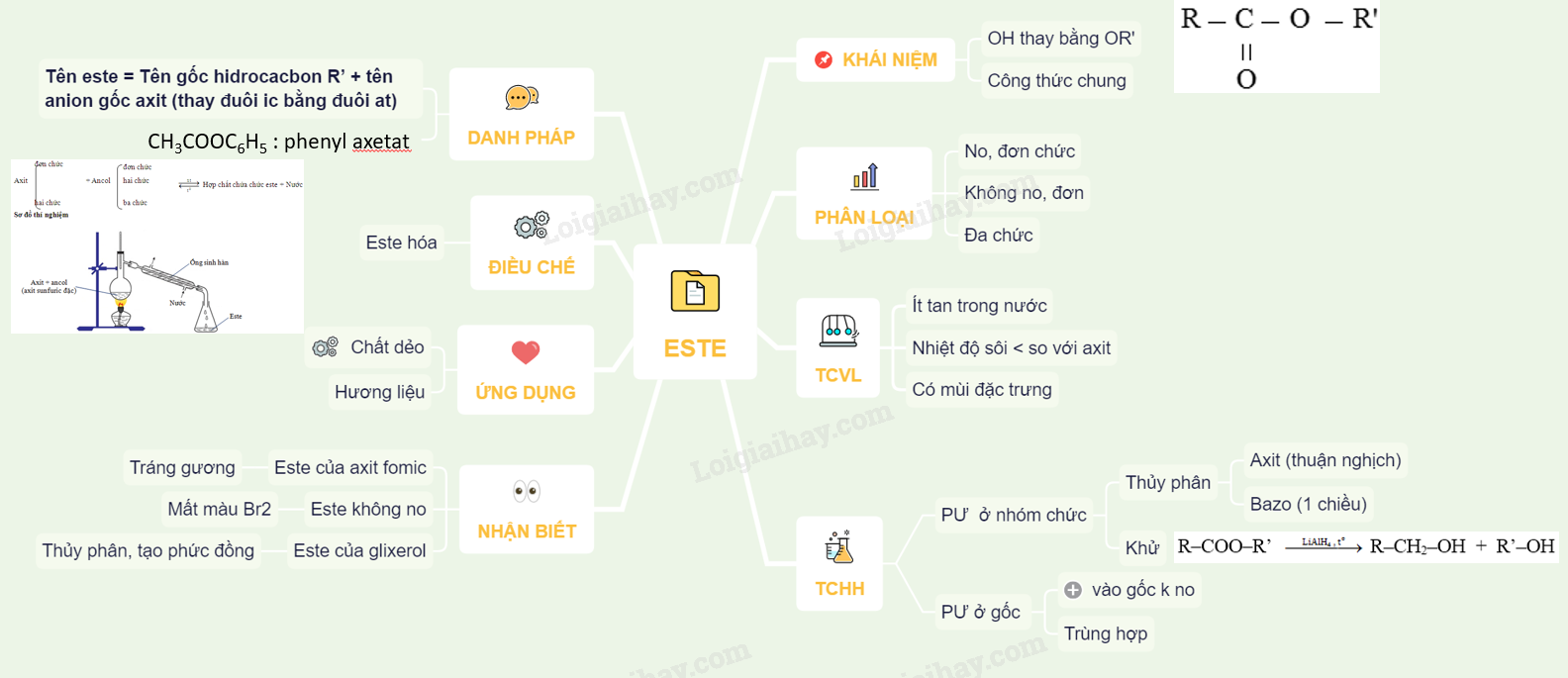
I. KHÁI NIỆM:
VD: CH3COOH + C2H5OH $\overset {{H_2}S{O_4},\,{t^0}} \leftrightarrows $ CH3COOC2H5 + H2O
=> ĐN: Khi ta thay thế nhóm (-OH) trong phân tử axit bằng gốc (-OR’) thì thu được este
RCOOH → R – COOR’ (R’ ≠ H)
Chú ý: Cách viết khác của este
R – COO – R’ hoặc R’ – OOC – R hoặc R’ – OCO – R (R’≠ H)
R là gốc xuất phát từ axit, còn R’ là gốc xuất phát từ ancol
II. PHÂN LOẠI
1. Este no, đơn chức: CnH2nO2 (n ≥ 2)
2. Este không no đơn chức:
– Este đơn chức, mạch hở, không no : CmH2m+2-2kO2 (k là số liên kết pi, k ≥ 2)
VD: Este đơn chức, mạch hở, không no và có chứa 1 liên kết đôi: CmH2m-2O2
3. Este đa chức:
– Este tạo bởi axit đơn chức và rượu đa chức có dạng: (RCOO)mR’
– Este tạo bởi rượu đơn chức và axit đa chức có dạng: R (COOR’)m
– Este tạo bời axit đa chức R(COOH)n và ancol đa chức R’(OH)m có dạng: Rm(COO)nmR’n
III. DANH PHÁP
Tên este = Tên gốc hidrocacbon R’ + tên anion gốc axit (thay đuôi ic bằng đuôi at)
– Tên một số gốc axit thường gặp:
HCOO-: Fomat CH3COO-: Axetat
CH2=CHCOO-: Acrylat C6H5COO-: Benzoat
– Tên một số gốc R’ thường gặp:
CH3-: metyl; C6H5- : phenyl
C2H5-: etyl; C6H5CH2- : benzyl
CH2=CH-: Vinyl
Ví dụ: CH3COOC6H5 : phenyl axetat
IV. TÍNH CHẤT VẬT LÍ
– Là chất lỏng hoặc chất rắn ở điều kiện thường, ít tan trong nước
– Có nhiệt độ sôi thấp hơn nhiều so với các axit có cùng khối lượng mol hoặc các phân tử có cùng số C, do trong este không có liên kết hidro
– Các este thường có mùi đặc trưng
Isoamyl axetat (CH3COOCH2CH2(CH3)2): mùi thơm của chuối.
Etyl isovalerat ((CH3)2CHCH2COOC2H5): mùi táo.
Etyl butirat (CH3CH2CH2COOC4H9): mùi dứa.
Geranyl axetat (CH3COOC10H17): mùi hoa hồng …
Benzyl propionat: CH3CH2COO-CH2C6H5: mùi hoa nhài.
V. TÍNH CHẤT HÓA HỌC
1. Phản ứng ở nhóm chức
a) Phản ứng thủy phân.
+ Trong môi trường axit :
RCOOR’ + H2O ![]() RCOOH + R’OH.
RCOOH + R’OH.
+ Trong môi trường bazơ : Phản ứng xà phòng hóa.
RCOOR’ +NaOH \(\overset{t^{o}}{\rightarrow}\) RCOONa + R’OH.
* Một số phản ứng thủy phân đặc biệt của este:
– Este của phenol tham gia phản ứng xà phòng hóa sinh ra 2 muối:
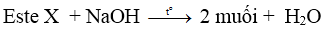
– Một số este có dạng đặc biệt thủy phân sinh ra andehit, xeton
RCOOCH=CH-R’ + NaOH → RCOONa + R’CH2-CHO + H2O
RCOOC(R’)=R’’ + NaOH → RCOONa + R’-CO-R’’ + H2O
– Este – axit, có công thức là HOOC–R–COOR’
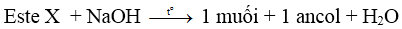
– Este vòng (được tạo bởi hiđroxi axit)
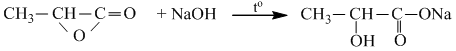
b) Phản ứng khử
Este bị khử bởi liti nhôm hiđrua (LiAlH4), khi đó nhóm RCO– (gọi là nhóm axyl) trở thành ancol bậc I:
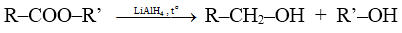
2. Phản ứng ở gốc hidrocacbon
Dựa vào đặc điểm của gốc hidrocacbon, este có thể tham gia được phản ứng thế, cộng, trùng hợp, …..
a) Phản ứng cộng vào gốc không no
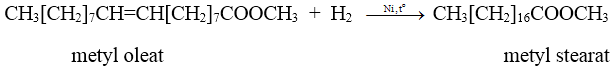
b) Phản ứng trùng hợp
Một số este đơn giản có liên kết C = C tham gia phản ứng trùng hợp giống như anken.
VI. ĐIỀU CHẾ
– Thường được điều chế bằng phản ứng este hóa
RCOOH + R’OH ![]() RCOOR’ + H2O
RCOOR’ + H2O
– Một số este có phương pháp điều chế riêng, ví dụ như vinyl axetat được điều chế qua phản ứng sau:
\(C{{H}_{3}}COOH+CH\equiv CH\xrightarrow{{{t}^{o}},xt}\)\(C{{H}_{3}}COOCH=C{{H}_{2}}\)
VII. ỨNG DỤNG
Được dùng làm dung môi để tách, chiết, sản xuất chất dẻo, làm hương liệu trong công nghiệp thực phẩm, mĩ phẩm…
VIII. NHẬN BIẾT ESTE
– Este của axit fomic có khả năng tráng gương.
– Các este của ancol không bền bị thủy phân tạo anđehit có khả năng tráng gương.
– Este không no có phản ứng làm mất màu dung dịch Brom.
– Este của glixerol hoặc chất béo khi thủy phân cho sản phẩm hòa tan Cu(OH)2.
Sơ đồ tư duy: Este