Lưu huỳnh là gì? Tính chất đặc trưng và những ứng dụng phổ biến nhất
Đốt quặng pirit sắt (fes2): 4fes2 + 11o2 → 2fe2o3 + 8so2
những ứng dụng quan trọng của lưu huỳnh trong công nghiệp và đời sống
lưu huỳnh là một trong những nguyên tố liên quan đến nhiều lĩnh vực trong đời sống thực tiễn, góp vai trò quan trọng trong.
n gi
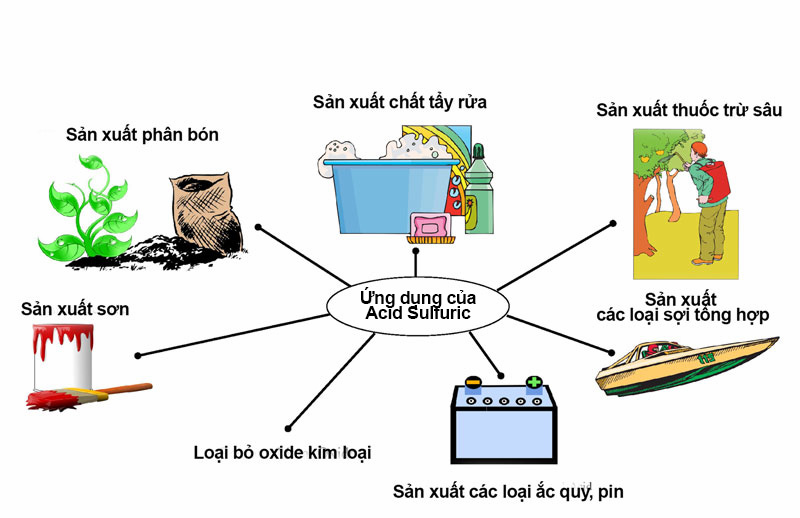
Ứng dụng của lưu huỳnh trong công nghiệp
Trong Công NGHIệP, 90% LượNG LưU HUỳNH ượC Khai Tháp Thông qua dẫn xuất chính là là axít sulfuric (H2SO4), đây ượC đánh Giá Là Một Trong Cácy việc tiêu thụ sulfuric acid còn được coi là một trong các chỉ số tốt nhất về sự phát triển công nghiệp của một quốc gia. lưu huỳnh được sản xuất ở hoa kỳ hàng năm nhiều hơn bất kỳ hóa chất công nghiệp nào khác.

lưu huỳnh được sử dụng trong nhiều sản phẩm công nghiệp, ví dụ như: Ắc quy, bột giặt, lưu hóa cao su, thuốphàc diấ nc.mt v. cụ thể, được lưu huỳnh được sử dụng để tạo nên độ trắng của giấy, làm chất bảo quản trong rượu vang khô. do bản chất dễ cháy, lưu huỳnh còn được ứng dụng trong sản xuất các loại diêm, thuốc sung, thuốc nổ cũng như pháo hoa…
Ứng dụng của lưu huỳnh trong làm đẹp
Đang xem: Bài ca Côn Sơn (Côn Sơn ca – trích)
từ xa xưa, with người đã biết ứng dụng lưu huỳnh trong việc làm đẹp da và trị mụn trứng cá. tuy nhiên, hiện nay vẫn chưa có nghiên cứu rõ ràng nào tìm ra cách hoạt động của nguyên tố này trong việc điều trị mụn.
qua thực nghiệm, người ta ưa ra kết lận: lưu huỳnh có khả năng kHáng viêm và kháng khuẩn cao, từ đó Có khả nĂng khiến những nốt mẹp đp đp đp đp đt nht ct.

Ứng dụng của lưu huỳnh trong nông nghiệp
bên cạnh những ứng dụng quan trọng bậc nhất của ngành công nghiệp, trong lĩnh vực nông nghiệp, lưu huỳnh cũng được xem như một trong những nguyên liệu để chế tạo phân bón hóa học, thuốc trừ sâu, thuốc diệt nấm…
Ứng dụng lưu huỳnh trong and học
lưu huỳnh cũng thể hiện vai trò của mình trong y học. magnesi sulfat có thể ược sử dụng như một loại thuốc nhuận tràng và điều trị các bệnh liên quan ến rối loạn về da với khángtính ề ca kheng khángtính n.
vi dụ: kem, sữa dưỡng da, thuốc mỡ hoc xà pHòng lưu hu ỳnh dùng điều trị mụn trứng ca, thuốc mỡu lưu hu huỳnh dùng ể điều trị viêm da tiết bã, ghẻ …
xem them:
- nhóm halogen là gì? vị trí, đặc điểm, tính chất, cấu hình electron
- iot là gì? tính chất và những ứng dụng phổ biến nhất
Đau đầu: so2 sẽ xâm nhập vào cơ thể sau đó ngấm vào máu và làm ảnh hưởng đến hệ thần kinh khi con ngườgi hít. chính vì vậy, ngay khi ngửi phải mùi của lưu huỳnh, bạn sẽ thấy đau đầu, tùy theo nồng độ mùi.
In theo nồng độ.
khó thở : SO2 đi vào trong cơ thể sẽ làm giảm dự trữ Lượng kiềm trong Máu gây rối loạn chuyển hoá ường và protein, gây thiếu vitamin b và c, tắc nGhẽn mau Điều này khiến người hít phải lưu huỳnh bị co hẹp dây thanh quản, khó thở.
víêm pHế quản: . sau đó, chúng xâm nhập qua phổi và gây ra những bệnh lý về phổi khác nhau trong đó có viêm phế quản.
tử vong: khi lưu huỳnh đi vào cơ thể ở nồng độ cao, máu bị ngộ độc, hệ thần kinh bị tác động, phổi bợng hƟ. từ đó khiến các cơ quan quan trọng tê liệt, có thể dẫn đến tử vong.
như vậy, khi tiếp xúc trực tiếp với lưu huỳnh qua ường ngửi there are ăng, with người ều phải ối mặt với nhiều vấn ề về sức khỏe nghiêm tọng tọng tọng tù do đ nên tiếp xúc trực tiếp. Đối với những thực phẩm có tẩm lưu huỳnh, hãy rửa thật sạch với nước trước khi chế biến, sử dụng.
tác động đến sinh vật dưới nước
khi nguồn nước bị nhiễm lưu huỳnh công nghiệp, các sinh vật và vi sinh vật sống dưới nước có thể bị ảnh hưởng tr᪣m. Điển hình như cá, tôm, cua, ngao, sò,… chúng sẽ bị ngộ độc lưu huỳnh và chết hàng loạt. nguy hiểm hơn, khi ăn phải các loại sinh vật này, with người cũng có nguy cơ rất cao bị nhiễm độc lưu huỳnh gián tiếp.
tác động đến môi trường sống
khi ốt lưu huỳnh ở nhiệt ộ cao, môi trường sống sẽ bịyy hoại nghiêm trọng, gây ô nhiễm môi trường khí, biến ổi khí hậu, mưa axit, hiệu ứNg ứNg ứ
Ô nhiễm môi trường: lưu huỳnh đioxit là tác nhân gây ô nhiễm môi trường.
In chứa so2 1- 2 ppm trong vài giờ).
phá hủy tầng ozon: so2 + o3 → so3 + o2
ô nhiễm nguồn nước : hydrogen sulfide (H2S) – một loại khí ược hình thành do sự pHân hủy các chất hữu cơ là một trong những nguyên nhân gây ô nhi chất này thường được tìm thấy chủ yếu trong nước giếng khoan. khi nước chứa hàm lượng h2s thấp khoảng 1.0 ppm sẽ có đặc tính ăn mòn. lúc này, nó trở thành axit gây ăn mòn kim loại, bê tông và khiến thay ổi tính chất vật lý, màu sắc của đá vôi, đá hoa, phá hủy gủy kiến, g. chou vải sợi, giấy xuất hiện chấm đen…
lưu ý khi sử dụng và cách lưu trữ, bảo quản lưu huỳnh
vì tính chất ộc hại của nó, khi sử dụng lưu hu ỳnh, bạn cần lưu ý những yếu tố sau đy ể ể ể ể gây r.
sử dụng lưu huỳnh cần lưu ý những gì?
Đối với các hợp chất của lưu huỳnh, bạn cần thận trọng khi tiếp xúc với các hợp chất này (chẳng hạn sulfide carbon huỳnh).
khi sử Dụng thuốc lưu huỳnh, bạn cần chú ý tới liều lượng dùng thuốc lưu huỳnh, thời gian sử dụng, hướng dẫn sửng và nghe theo sự sự sự sự sự sự sự sự sự sự sự sự chuyên mon.
cách lưu trữ và bảo quản lưu huỳnh
Đối với hóa chất lưu huỳnh, bạn cần bảo quản nơi khô ráo, thoáng mát, tránh ánh nắng trực tiếp củstronga mặt tr.u vt
ối với thuốc lưu hu ỳnh, bạn cần bảo quản ở nhiệt ộ ộ ộ pHòng, traánh nơi ẩm ướt và traránh ang nắng mặt trời, tuyt ốt ốt ốt ốt ốt ốt ốt ốt ốt ốt b.dánhánhánhán. phòng tắm hoặc ngăn đá. với thuốc hết hạn sử dụng, ừng tự ý vứt thuốc lưu huỳnh vào toille hoặc ường ống dẫn nước, hãy tham khảo ý kiến của dược sĩc >
một số hợp chất phổ biến của lưu huỳnh
Ở phần này, chúng ta cùng tìm hiểu một số hợp chất phổ biến của lưu huỳnh và đồng vị của nó.

sulfua hydro: hợp chất chính của lưu huỳnh là sunfua hydro, có mùi trứng thối đặc trưng. khi hoà tan trong nước, hợp chất này có tính axit và phản ứng với nhiều kim loại để tạo ra các sunfua kim loại. các sunfua kim loại này khá phổ biến, nhất là của sắt (còn được gọi là pyrit).
êtyl và mêtyl mecaptan : hợp chất khác của lưu huỳnh như êtyl và mêtyl mecaptan có mùi khó ngửi và ược sửng làm chất tạo mùi cho khí ố >
nitrua lưu huỳnh polyme Hóa : ược tạo ra từ têtranitrua têtra lưu huỳnh s4n4 – một hợp chất có các tính chất của kim loại mặc dù không chứt k ạt k ạt k ạt k ạt k ạt k ạt k ạt k ạt k ạt k ạt k ạt k ạt k ạt k ạt k chúng có các tính chất quang học và điện bất thường và polyme này có thể tạo ra từ têtranitrua têtra lưu huỳnh s4n4.
bên cạnh đó, một số hợp chất quan trọng khác của lưu huỳnh có thể kể đến như:
một số hợp chất vô cơ:
sulfua (s2-)
sulfite (so32-), các muối của axit sulfurơ, h2so3, axít sulfurơ và các sulfit tương ứng, pyrosulfite ion, metabisulfite (s2o52−).
sulphate (so42-) và các muối của sulfuric axit.
thiosulfate (đôi khi được gọi là thiosulfite hay “hyposulfite”) (s2o32−)- như thiosulfate natri.
Đithionit natri, na2s2o4 tạo ra từ axít hyposulfurơ/đithionơ.
Đithionat natri (na2s2o6)
polythionic axit (h2sno6)
axít perôxymônôsulfuric (h2so5) và axít peroôxyđisulfuric (h2s2o8)-
natri polysulfide (na2sx)
hexaflorua lưu huỳnh, sf6
têtranitrua têtra lưu huỳnh s4n4
một số hợp chất hữu cơ:
Đimêtyl sulfôniôprôpiônat (dmsp; (ch3)2s+ch2ch2coo-)
thiol (hay mecaptan)
thiolate
sulfôxít
sulfon
thuốc thử lawesson
naptalen-1,8-điyl 1,3,2,4-đithiađiphốtphetan 2,4-đisulfua
Đồng vị: lưu huỳnh có tất cả 18 đồng vị trong đó có 4 đồng vị ổn định: s32 (95.02%), s33 (0.75%), s34 (4, 21%) vs. 36 (0.02%).
bài tập về lưu huỳnh sgk hóa học 10 kèm lời giải
những bài tập về lưu huỳnh sgk Hóa lớp 10 ược trình bày chi tiết, dễ hiểu nhất dưới đy sẽ giúp bạn hiểu riqute về lưu huỳnh cùng nhng aunt
bai tập 1 trang 132 sgk hóa 10
lưu huỳnh tác dụng với axit sunfuric đặc, nóng:
s + 2h2so4 → 3so2 + 2h2o
Đang xem: Top 1001 tên đẹp để đặt con trai, con gái hay mang lại MAY MẮN nhất
trong phản ứng này, tỉ lệ số nguyên tử lưu huỳnh bị khử: số nguyên tử lưu huỳnh bị oxi hóa là:
a. 1 : 2.
b. 1 : 3.
c. 3 : 1.
d. 2 : 1.
chọn đápán đúng.
gợi ý đáp án: d là đáp án đúng.
s là chất khử (chất bị oxi hóa) ⇒ số nguyên tử s bị oxi hóa là 1
h2so4 là chất oxi hóa (chất bị khử) ⇒ số nguyên tử s bị khử là 2
→ tỉ lệ số nguyên tử s bị khử: số nguyên tử s bị oxi hóa là: 2:1
bai tập 2 hoá 10 sgk trang 132
¿dãy đơn chất nào sau đây vừa có tính oxi hóa vừa có tính khử?
a. cl2, o3, s.
b. s, cl2, br2.
c. na, f2, s.
d. br2, o2, ca.
gợi ý đáp án: b là đáp án đúng
bai tập 3 sgk hóa 10 trang 132
thể dự đoán sự thay ổi như thế nào về khối lượng riêng, về nhiệt ộ nóg chảy khi giữ lưu huỳnh ơn tà (sb) dài ngày ở nhiệt ộ ộ ộ ộ ộ ộ ộ ộ ộ ộ ộ ộ ộ ộ ộ ộ ộ ộ ộ ộ ộ ộ ộ ộ
gợi ý đáp án:
khối lượng riêng của lưu huỳnh tăng dần.
nhiệt độ nóng chảy của lưu huỳnh giảm dần.
bai tập 4 trang 132 sgk hóa 10
Đun nóng một hỗn hợp gồm có 0.650g bột kẽm và 0.224g bột lưu huỳnh trong ống nghiệm đậy kín không có không khí. sau phản ứng, người ta thu được chất nào trong ống nghiệm? khối lượng là bao nhiêu?
gợi ý đáp án:
n(zn) = 0.65/65 = 0.01mol
n(s)= 0.224/32 = 0.007 moles
—> s phản ứng hết, zn phản ứng dư
phương trình hóa học của phản ứng
zn + s → zns (nhiệt độ)
nzn phản ứng = 0.007 mol ⇒ nzns = 0.007 mol.
khối lượng các chất sau phản ứng:
mzn dư = (0.01 – 0.007) × 65 = 0.195 g.
mzns = 0.007 × 97 = 0.679 g.
bai tập 5 hoá 10 sgk trang 132
1.10 g hỗn hợp bột sắt và bột nhôm tác dụng vừa đủ với 1.28 g bột lưu huỳnh.
a) viết các phương trình hóa học của phản ứng xảy ra.
b) tính tỉ lệ phần trăm của sắt và nhôm trong hỗn hợp ban đầu, theo:
lượng chất.
khối lượng chất.
gợi ý đáp án:
a) phương trình hóa học của phản ứng
fe + s → fes
2al + 3s → al2s3
b) gọi nfe = x mol, theo pt ⇒ ns (1) = nfe = x mol
gọi nal = y mol, theo pt ⇒ ns (2) = (3/2). end = (3/2). and mole
⇒ ns = x + (3/2). y = 0.04 mol.
mhh = 56x + 27y = 1.1.
giải hệ phương trình ta có x = 0.01 mol, y= 0.02 mol.
tỉ lệ % sắt và nhôm trong hỗn hợp theo lượng chất ( theo số mol là):
%n(fe) = x/(x+y). 100% = 30%
%n(al) = 70%
tỉ lệ phần trăm của sắt và nhôm trong hỗn hợp theo khối lượng chất:
bad = 0.02 x 27 = 0.54g
mfe = 0.01 x 56 = 0.56g.
% poor = (0.54/11) × 100% = 49.09%
%mfe = 100% – 49.09% = 50.91%
vậy lưu huỳnh là gì, lưu huỳnh có độc không, có những tính chất nào? chắc hẳn qua bài viết trên đây của monkey, bạn đã có câu trả lời chi tiết và rõ ràng nhất. hy vọng bài viết này sẽ giúp ích bạn trong quá trình học tập của bản thân. truy cập website của monkey để có thêm nhiều thông tin về các nguyên tố hóa học thú vị khác!
Tham khảo: Tả hoạt động của cô giáo trong một tiết học hoặc một buổi học lớp em
lưu huỳnh có độc không? những ảnh hưởng tiêu cực của lưu huỳnh đến môi trường và con người
khi tìm kiếm các thông tin liên quan đến “tác hại của lưu huỳnh” trên google, người dùng có được 4,610,000 kết quả giây 0.35. vậy lưu huỳnh có thật sự độc không, và tác hại của nó là gì?

lưu huỳnh có độc không?
lưu huỳnh là một nguyên tố hóa học độc hại nếu sử dụng với hàm lượng lớn. MặC Dù Lưu huỳnh dioxide khá an toàn khi ược sửng một lượng nhỏ, nhưng khi ở nồng ộ cao với một liều lượng ủ lớn, no phản ứng với hơi ẩm ể các cơ quan khác.
những ảnh hưởng tiêu cực của lưu huỳnh
lưu huỳnh công nghiệp là hóa chất độc hại không được phép sử dụng trong chế biến và bảo quản thực phẩm. tuy nhiên ở nước ta, vì yếu tố lợi nhuận, tình trạng lạm dụng lưu huỳnh công nghiệp rất pHổ biến trong bảo quản tẩm sấy các dược liệu… gây tá sung.
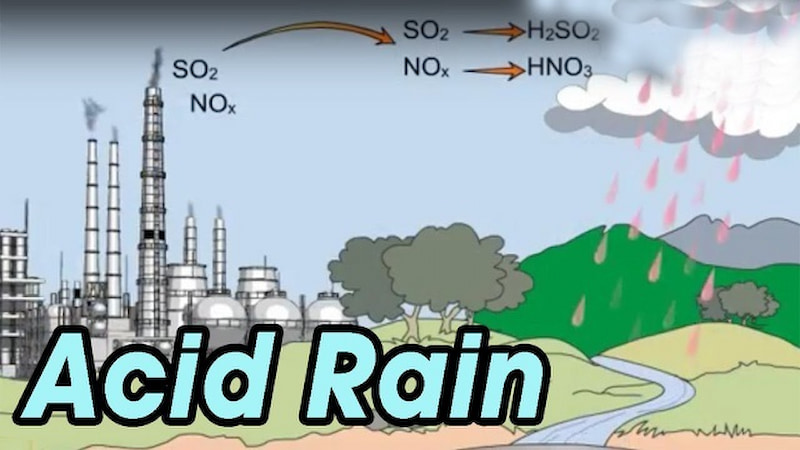
tác động đến sức khỏe with người
theo khuyến cáo của tổ chức y tế thế giới (who), hàm lượng so2 có trong các loại thực phẩm không được vượt quá 20 mg/1 kg. nhưng nhưng ở việt nam, lượng lưu huỳnh được sử dụng cao hơn rất nhiều lần so với mức độ cho phép. không chỉ ảnh hưởng đến cơ thể qua đường tiêu hóa, lưu huỳnh còn gây hại cho con người thông qua việc ngửi chúng.
khi ngửi mùi lưu huỳnh quá nhiều hoặc tiếp xúc trực tiếp với khí lưu huỳnh khi cháy sẽ gây ra các vấn đề về sức ỏe. Điển hình là:






